Очень разбавленные растворы кислот или щелочей с постоянным значением рН нельзя получить путем разбавления сильных кислот или оснований, т.к. незначительное количество СО2 из воздуха, щелочей из стекла посуды или загрязнений в дистиллированной воде могут заметно изменить реакцию таких растворов. Однако, в лаборатории часто требуется иметь раствор с вполне определенным и постоянным значением рН. Такие растворы готовят смешиванием слабых кислот или слабых оснований с их солями.
Рассмотрим раствор, содержащий СН3СООН и СН3СООNa. Из уравнения константы ионизации уксусной кислоты следует:
При введении в раствор хорошо диссоциирующего CH3COONa диссоциация кислоты подавляется. В результате этого концентрация недиссоциированных молекул СН3СООН становится почти равной общей концентрации кислоты, а концентрация СН3СОО равна общей концентрации соли. Тогда предыдущее уравнение можно записать:
Так как К – постоянная величина, то концентрация водородных ионов в таком растворе будет определяться отношением концентрации кислоты к концентрации соли. Разбавление этого раствора практически не изменит его рН.
Даже добавление некоторого количества сильной кислоты не повлияет заметно на рН такого раствора, т.к. введенные ионы Н+ свяжутся с анионом в недиссоциирующие молекулы слабой кислоты. Почти не изменится рН и при добавлении щелочи.
Растворы слабой кислоты и её соли (или слабого основания и его соли), концентрация водородных ионов в которых почти не меняется при введении в них сильной кислоты или сильного основания, называются буферными растворами. Они играют большую роль в регулировании жизненных процессов в организмах животных и растений, широко применяется в лабораторной практике.
Примерами буферных систем могут служить аммиачные растворы (NH4OH+NH4Cl) и ацетатные растворы (СН3СООН+СH3COONa) и др. + смеси солей разной кислотности: NaH2PO4+Na2HPO4 (5,3–8) NaHCO3+Na2CO3 и т.п. В этом случае кислый анион заменяет слабую кислоту. К примеру, рН последнего раствора можно рассчитать, используя формулу
Если взять одинаковые количества кислоты и соли, то и тогда рН=рКд.к.
В рассматриваемом случае используется значение константы диссоциации Н2СО3 по второй ступени, откуда рН = р(4,8·10-11) = 10,32.
Следовательно, карбонатный буферный раствор создает щелочную среду.
| Величина рН | крови человека | = 7,45 – 7,35 |
| слезы | = 7,4 | |
| желудочного сока | = 0,9 |
В сельском хозяйстве рН характеризует кислотность почв, засухо и морозоустойчивость растений и т.д.
рН природных вод является важным экологическим, гидрохимическим, гидрогеологическим показателем.
Величина рН используется для контроля и автомат. регулирования производства в гидрометаллургии, нефтяной, химической, бумажной, пищевой и др. областях промышленности.
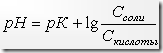
Комментариев нет:
Отправить комментарий