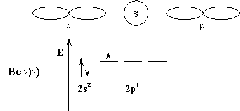
sp2 – гибридизация.
Три различные атомные орбитали (АО), комбинируясь друг с другом, образуют 3 одинаковые гибридные орбитали. Получаются три равноценные гибриды, расположенные под углом в 120˚ относительно центра координат. В качестве примера можно привести молекулы Ga, Zn, Te с галогенами и также бора.
 | ||||||
 | ||||||
| ||||||
 |
Образуются три равноценные орбитали. Образуют правильный треугольник.
В молекуле органических соединений, например в этилене, - sp2 гибридизация.
sp3 – гибридизация
Гибридизация одной s и трех p – орбиталей характерна для углерода, Si и германия. Гибридные sp3 орбитали на ¼ имеют характер s – орбитали и на ¾ - p – орбитали, поэтому у них более вытянутая форма, чем у sp2 – орбиталей, и от центра атома они расходятся под углами 109˚ к вертикали тетраэдра.
Подобный тип гибридизации имеется в атомах С- углерода, азота в NH4+; TiCl4 и др. Из органических веществ в этане, метане (CH4).

В молекуле воды только четыре из восьми электронов, занимающих гибридные sp3 орбитали атома кислорода образуют связи О – Н, а две электронные пары остаются неподеленными, т.е. принадлежат только атому кислорода.
 |
Комментариев нет:
Отправить комментарий