Насыщаемость
Максимальная ковалентность у элементов 2го периода равна 4, т.к. на внешнем энергетическом уровне у них находятся 4 орбитали (s и p) и может разместиться максимум 8 электронов 2s2 2p6 (2+6=8) 8:2=4.
Атомы элементов 3го периода и т.д. имеют и d-орбитали и ковалентность может = 9; 3s23p63d10 (2+6+10=18); 18:2=9.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей называется насыщаемостью.
Направленность
Свойства молекулы, её способность вступать в химическое взаимодействие с другими молекулами (реакционная способность) зависят не только от прочности химических связей в молекуле, но в значительной мере и от её пространственного строения. Этот раздел химии называется стереохимией.
Образование ковалентной связи осуществляется за счет перекрывания электронных облаков взаимодействующих атомов. При этом область перекрывания располагается в определенном направлении к атомам. Иначе говоря обладает направленностью.
Например, молекула водорода.

В образовании σ связи могут принимать участие и р-электроны. Например: HF
| F 2)7) | H 1) |
|
|
|
|
|


Пи связь и сигма неравноценны, т.к. энергия из разрыва различна.
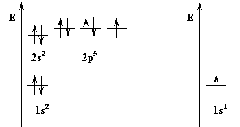



Комментариев нет:
Отправить комментарий