Наибольший успех водородная теория кислот приобрела в 1923 году, когда Брекстед в Дании и Лоури в Англии независимо друг от друга предложили считать, что кислота – это вещество, стремящееся отдать протоны (донор), а основание – вещество, стремящееся присоединить протоны (акцептор). По их теории гидроксилсодержащие вещества являются основаниями, но основаниями являются также такие вещества как пиридин, аммиак и другие молекулы и ионы.
По Брекстеду кислота сохраняет свои свойства и в присутствии и в отсутствии растворителя, т.е. HCl, есть кислота, т.к. отдает ион водорода, а не потому, что она отдает его в водном растворе. Таким образом ограничений водной среды нет и реакции возможны в любой среде.
Чтобы кислота отдала протон необходимо присутствие основания, принимающего протон. Им является вода.
ион Cl– не связывается с ионом гидроксония реакция идет только слева направо, т.к. вода является слабым основанием. Но если растворенное вещество более основное, чем вода, то вода сама отдает свой протон и становится кислотой.
Поэтому можно сказать, что вода – амфотерный растворитель. Относительная сила кислот и оснований по протонной теории может быть определена почти также, как по теории Аррениуса.
В сопряженной паре кислота – основание всегда сильному донору сопутствует слабый акцептор.
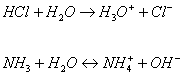
Комментариев нет:
Отправить комментарий