В зависимости от структуры вещества процесс протекает по-разному:
1) если структура вещества ионная
2) если молекула полярна

Но если ионы KCl притягивают к себе молекулы воды, то и вода притягивает к себе ионы K+ и Cl–.
Притянутые молекулы воды испытывают толчки со стороны других молекул и происходит растворение вещества в воде.
Иначе происходит диссоциация полярных молекул. Молекула при растворении поляризуется, т.е. её полюса расходятся и в конечном итоге гидратируются. Оказывается, что ион водорода прочно связан в этот момент с молекулами воды, т.е. он образует ион гидроксонил.
К слабым электролитам принадлежат в первую очередь слабые кислоты и слабые основания и некоторые соли. Сюда относятся большинство органических кислот, фенолы,амины, некоторые неорганические основания и кислоты (угольная, синильная), а также соли – хлорная ртуть, цианистая ртуть и др.
Сильные электролиты почти полностью диссоциированы на ионы.
Процесс диссоциации слабых электролитов является обратимым, т.к. ионы противоположного знака, встречаясь в растворе, могут вновь соединяться в молекулы.
Как и во всяком обратимом процессе, здесь устанавливается равновесие. Количество его характеризуется константой равновесия (константой диссоциации Kg), определяемой уравнением:
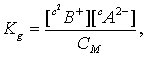
– концентрации соответствующих ионов и недиссоциированных молекул электролита. Это уравнение применимо к слабым электролитам в разбавленных растворах. В более концентрированных растворах необходимо пользоваться активностями, вместо концентраций (а = с).
Активность можно рассматривать как величину, характеризующую степень связанности частиц электролита, т.е. это реально действующая масса в отличие от общей концентрации вещества в раствор. В этом случае уравнение принимает вид:

, а – активность, f – коэффициент активности
– активности ионов и недиссоциированных молекул электролита.
Эту константу называют термодинамической константой диссоциации. Рассчитанная таким образом может несколько изменяться с концентрацией. Её называют условной константой диссоциации.
Наряду с для характеристики состояния слабого электролита, в растворе пользуются также и величиной степени диссоциации α.
Константа диссоциации – это величина свойственная данному электролиту. При постоянной t˚ и в одном и том же растворителе она должна быть величиной постоянной. А степень диссоциации α характеризует состояние электролита в растворе только определенной концентрации и меняется с её изменением.
С уменьшением концентрации она возрастает, приближаясь к 1 (единице). И наоборот, с увеличением концентрации вероятность встречи ионов в растворе и их соединения в недиссоциированные молекулы возрастает, а степень диссоциации уменьшается. Степень диссоциации связана с константой диссоциации. Так для бинарного (двойного) электролита ВА, т.е. образующего по два иона, концентрации ионов и концентрация недиссоциированных молекул
связана с общей концентрацией электролита с:
Подставив эти значения в выражение
, получим:
, т.е. Закон разбавления Оствальда
В уравнение, в котором диссоциация электролита очень мала, этот закон упрощается, т.к. , то
или
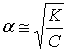

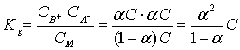
Комментариев нет:
Отправить комментарий