Вопросы химической связи, образования молекул из атомов и строения самих молекул давно привлекали к себе внимание ученых. Все многочисленные химические процессы происходят в результате перегруппировок атомов, разрывом старых связей между ними и образованием новых. До открытия атомно-молекулярного учения химическую связь невозможно было понять.
В начале XIX века Бертолле (1800) предложил гравитационную теорию химической связи, согласно которой взаимодействие частиц обусловлено силами всемирного тяготения. Но при сравнении сил химического сродства и тяготения (при образовании молекулы Н2) показывает, что первые в 1035 степени раз больше гравитационных сил. Одного этого достаточно, чтобы доказать несостоятельность концепции Бертолле. Согласно представлениям Бертолле, тяжелые элементы должны давать более прочные химические соединения по сравнению с легкими элементами. В действительности же опытный материал химии свидетельствует об обратном: легкие элементы образуют друг с другом более прочные химические соединения.
По электрохимической теории Берцелиуса (1812г) в атомах одних химических элементов превалируют (+) полюсы, а в атомах других (-). Первые представляют собой металлы, а вторые – неметаллы. Химическое взаимодействие металлов и неметаллов объяснялось притяжением разноименных полюсов, т.е. Берцелиус рассматривал образование химических соединений при взаимодействии электроположительных и электроотрицательных элементов. Несостоятельность этой теории очевидна, т.к. существуют электронейтральные атомы и прочные молекулы из одинаковых атомов (N2, O2 и т.д.).
Впервые понятие о валентности было введено в химию английским химиком Франклендом в 1853 году. Под валентностью, или атомностью, он понимал число атомов другого элемента, соединяющегося с одним атомом данного элемента. Если принять валентность водорода равной единице, то валентности других элементов определяются как число атомов водорода, соединяющиеся с одним атомом рассматриваемого элемента. Франклендом была обнаружена N, P, As и четырехвалентность углерода (вместе с Кольбе). В дальнейшем представления о валентности сыграли исключительно важную роль в теории химического строения Бутлерова (1861г). Основные положения этой теории кратко можно сформулировать так;
1) химическая связь обладает специфической особенностью – насыщаемостью, поэтому валентность элемента выражается числом связей его атома;
2) единицы химической связи обозначаются черточками.
атом углерода обладает четырьмя единицами связи (так возникли структурные формулы);
3) химическая природа вещества зависит от его строения и, наоборот, определенному строению отвечает определенная совокупность свойств;
4) все атомы, входящие в молекулу, связанные друг с другом взаимно влияют друг на друга. Однако, сущность природы химической связи оставалась нераскрытой.
Итак, валентонсть отражает форму химического взаимодействия элементов, а химическая связь – его содержание.
Теория химического строения ввела в науку представление о взаимном влиянии атомов в молекулах. Оказалось, что в молекуле взаимодействуют не только непосредственно связанные атомы, но имеет место взаимное влияние всех атомов.
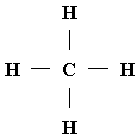
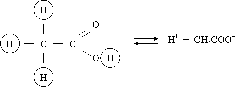
Так, свойства атома водорода существенно меняются в зависимости от того, соединен ли он с атомом Cl в HCl, с O в H2O или с N в NH3, или же его свойства меняются в CH3COOH от того с чем он соединен.
Рассказать о структурных формулах. Теория химического строения объяснила явление изомерии. Изомеры – это вещества, обладающие одним и тем же качественным и количественным составом, но разными свойствами. Присуща в основном органическим веществам, хотя известна и среди неорганических соединений (комплексные соединения).
Пример:
Необходимой предпосылкой создания теории химической связи было выяснение строения атома. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории. В 1916 году Льюис американский физик – химик высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам. Эта теория была основой ковалентной связи. В этом же 1916 г. Коссель немецкий ученый предположил, что при взаимодействии двух атомов один их них отдает, а другой принимает электроны, при этом первый атом заряжается (+), а второй (-).
Дальнейшее развитие этой теории привело к созданию современных представлений ионной связи.
Обычно различают пять типов химической связи: ионную, ковалентную (полярную и неполярную), металлическую, связь обусловленную силами Ван–дер–Ваальса и водородную. Три первых очень прочны.
Комментариев нет:
Отправить комментарий