Все химическое реакции можно подразделить на 2 группы: обратимые и необратимые.
Необратимые – это реакции, протекающие до конца, т.е. до полного израсходования одного из реагирующих веществ.
Обратимыми –называются реакции, которые могут протекать в рассматриваемых условиях как в прямом, так и обратном направлениях. Когда хотят в самом уравнении реакции подчеркнуть обратимость её в данных условиях, то знак равенства заменяют двумя стрелками противоположного направления
Реакция, протекающая слева направо, называется прямой, а справа налево – обратной.
Рассмотрим реакцию:
K1 и К2 – константы скорости реакции при данной t˚.
Если в качестве исходного состояния принять систему из H2 и J2, то скорость взаимодействия между ними (V1) в начальный момент определяется исходными концентрациями этих веществ. Она будет зависеть также и от времени. И меняется по мере израсходования веществ. См. рис.
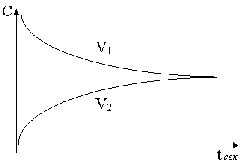 |
Если бы не было обратной реакции, то кривая достигла бы оси абсцисс и стала бы равной нулю, когда один или оба компонента израсходуются. Так как в момент начала реакции количество HJ равняется нулю, то V2 обратной реакции начинается с нуля и проходит начало координат. V2 увеличивается по мере образования HJ и со временем и пересекает кривую прямой реакции, т.е. скорости обеих реакций становятся равными; и скорость образования йодистого водорода равна скорости его разложения. Такое состояние химической системы называется химическим равновесием.
При данных условиях химический состав системы остается неизменным.
В настоящее время можно, пользуясь методом меченых атомов, измерить скорости реакций в условиях равновесия и экспериментально подтвердить этот вывод.
Критерием химического равновесия является равенство скоростей прямой и обратной реакций.
Так как K1 и К2 при данной t˚ являются величинами постоянными, то и КС д.б. в этих условиях тоже величиной постоянной. Она называется константой равновесия.
Соотношение определяемое равенством называется выражением константы равновесия или законом действия масс. Равенство характеризует предел, до которого может изменяться состав реакционной смеси. Таким образом, в условиях химического равновесия концентрации всех веществ, участвующих в реакции, связаны между собой и нельзя изменить ни одной из без того, чтобы это не повлекло за собой изменения концентрации всех остальных веществ. Соотношение между концентрациями, выражаемое константой равновесия, сохраняет постоянной для данной t˚ значение.
Для реакции:
Константа равновесия выражается равенством:
Наряду с выражением константы равновесия через концентрации реагирующих веществ для газовых реакций широко применяется также выражение её через их парциальные давления.

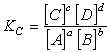
Комментариев нет:
Отправить комментарий