Ковалентная связь образуется за счет общей электронной пары.
 В невозбужденном атоме азота имеются 3 неспаренных электрона:
В невозбужденном атоме азота имеются 3 неспаренных электрона:
Следовательно, за счет неспаренных электронов атом азота образует 3 ковалентные связи. Это и происходит в молекуле N2 и NH3. Ковалентность здесь = 3.
Однако число ковалентных связей м.б. больше числа неспаренных электронов.
 Например:
Например:
 За счет неспаренных электронов углерод образует две ковалентные связи. Но для углерода характерны связи, где имеются 4 ковалентные связи. Это оказывается возможным, если один электрон в форме S перевести на р-подуровень. Такой процесс возбуждения, сопровождающийся «распариванием» электронов м.б. представлен следующей схемой:
За счет неспаренных электронов углерод образует две ковалентные связи. Но для углерода характерны связи, где имеются 4 ковалентные связи. Это оказывается возможным, если один электрон в форме S перевести на р-подуровень. Такой процесс возбуждения, сопровождающийся «распариванием» электронов м.б. представлен следующей схемой:
 Теперь во внешнем электронном слое находятся 4 неспаренных электрона. Отсюда, возбужденный атом может участвовать в образовании 4 ковалентных связей. Переход спаренного электрона на другой уровень (например, со 2го на 3ий) связан с затратой очень большой энергии, которая не покрывается энергией, выделяющейся при образовании новых связей. Поэтому у кислорода ковалентность всегда = 2, а Fфтора=1.
Теперь во внешнем электронном слое находятся 4 неспаренных электрона. Отсюда, возбужденный атом может участвовать в образовании 4 ковалентных связей. Переход спаренного электрона на другой уровень (например, со 2го на 3ий) связан с затратой очень большой энергии, которая не покрывается энергией, выделяющейся при образовании новых связей. Поэтому у кислорода ковалентность всегда = 2, а Fфтора=1.

Атомы третьего периода и др. имеют во внешнем слое d-подуровень, на который при возбуждении могут переходить s и p – электроны внешнего слоя.
При возбуждении у него может быть 3,5,7 неспаренных электронов.
Отсюда соединения хлора: HClO2 – хлористая кислота, HСlO3 – хлорноватая кислота, HСlO4 – хлорная кислота.

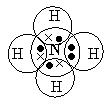
| из восьми электронов шесть образуют 3 ковалентные связи и являются общими для N и H. | |


II. Во многих случаях ковалентная связь возникает и за счет спаренных электронов, например, NH
3.
 Но 2 электрона принадлежат только азоту и образуют неподеленную электронную пару. Такая пара тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое у него есть свободная орбиталь. Например: у иона Н.
Но 2 электрона принадлежат только азоту и образуют неподеленную электронную пару. Такая пара тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое у него есть свободная орбиталь. Например: у иона Н.




![clip_image019[1] clip_image019[1]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEj6JXJLJLZRY9tSdUxf45zH6unt40q3dfaidDYjf0MFjoXfOjcnJa2fSr5JXiwD3DBYgsCBhOldwD9B9gXzesyqxbqySAGYTX9WW3Bl9X0FodQ17gYCi2ox4iMSTDJBrsoEnKNRbpQH9Ulb/?imgmax=800)

Поэтому при взаимодействии NH
3 + H
+ образуется ковалентная связь и неподеленная пара становится общей.
Общая пара электронов принадлежащая одному атому называется донорной, а свободная орбиталь другого атома (акцептором). Такой способ образования связи называется донорно-акцепторным.



 Атомы третьего периода и др. имеют во внешнем слое d-подуровень, на который при возбуждении могут переходить s и p – электроны внешнего слоя.
Атомы третьего периода и др. имеют во внешнем слое d-подуровень, на который при возбуждении могут переходить s и p – электроны внешнего слоя. 
 II. Во многих случаях ковалентная связь возникает и за счет спаренных электронов, например, NH3.
II. Во многих случаях ковалентная связь возникает и за счет спаренных электронов, например, NH3. 



Комментариев нет:
Отправить комментарий