Основу метода молекулярных орбиталей (М.О.) составляет представление о нелокализованных связях. При этом подразумевается, что в многоатомных системах (больших молекулах, кристаллах) валентные электроны одновременно принадлежат нескольким атомам. Нелокализованные π – связи имеются в органических веществах С4Н6 и С6Н6 и т.д., а также в неорганических веществах с сопряженными связями. Обычно это – O, N, S и некоторые другие, способные к образованию кратных связей. Например: ион  .
.
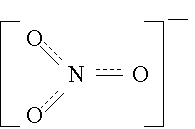
у N д.б. 5 валентностей, принадлежащих 3 кислородам.
Нелокализованные связи особенно характерны для металлических соединений. Атомы металлов содержат в своих внешних слоях мало электронов и, следовательно, много вакантных атомных орбиталей. Протекание процессов в сторону понижения внутренней энергии системы заставляет атомы образовывать максимально возможное число химических связей – химически насыщаться. Атомы металлов могут достичь этого лишь при их тесной взаимной упаковке в кристаллизационные структуры, в которых немногочисленные валентные электроны каждого атома будут обслуживать многие атомы, образовывая между ними нелокализованные связи.
Метод молекулярных орбиталей (МО) позволяет объяснить много фактов, трудно поддающихся объяснению. Например, какая связь в молекулярном ионе водорода Н2+ (энергия разрыва 259 кДж/моль).
Однако никакой элек. пары не образуется, т.к. в состав иона Н2+ входит всего один электрон и др.
Метод МО исходит из предположения, что состояние электронов в молекуле также может быть описано как совокупность молекулярных электронных облаков, причем каждой МО соответствует определенный набор молекулярных квантовых чисел (учитывая принцип Паули). Во многих случаях электронное облако принадлежит нескольким атомным ядрам и участвует в образовании многоцентровой химической связи. Таким образом, с точки зрения метода МО двухцентровая связь представляет собой лишь частный случай многоцентровой химической связи.
Электроны, находящиеся на связывающей МО, называются связывающими электронами.

В методе МО кратность связи принято определять по числу связывающих электронов, участвующих в её образовании.
Следовательно, с позиции метода МО химическая связь в молекуле водорода, образованную двумя связывающими электронами, следует рассматривать как простую связь, т.е. при образовании устойчивого молекулярного иона Н2+ единственный электрон переходит с атомной орбитали 1s на связывающую орбиталь σсв1s, что сопровождается выделением энергии.
 |
Комментариев нет:
Отправить комментарий