Понятие о стандартных потенциалах. Химические источники тока.
ЭДС гальванического элемента.
Уравнение Нернста.
Электрохимическая коррозия металлов. Коррозионный потенциал.
Основные методы защиты от коррозии. Электролиз расплавов и растворов.
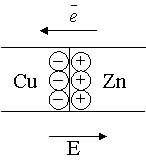
и
стержней в месте контакта возникает разность потенциалов.

возникает двойной электронный слой, за счет растворения металла в воде, обусловленное возрастанием энтропии (т.к. система стремится к неупорядоченному состоянию).
Металлический электрод заряжается отрицательно, в поверхностном растворе концентрируются (+) катионы Металла. Возникает контактная разность потенциалов из-за разности работ выхода электронов. Под работой выхода понимают количество энергии, которое необходимо затратить для удаления электрона из металла.
Величина электродного потенциала, т.е. скачка потенциала на границе металл – раствор, определяется прежде всего природой металла и раствора. Кроме того, она зависит от t˚, С и других факторов. Поэтому для сравнения электродных потенциалов выбираются стандартные условия: 25˚С – 298К, 1атм и в растворе с активностью одноименного иона = единице. (в 1 М растворе). Абсолютное значение электродных потенциалов измерить невозможно, в связи с этим измеряют разность потенциалов между данным электродом и электродом сравнения, потенциал которого условно принимают равным нулю. В качестве стандартного электрода сравнения используется водородный электрод.
Его изготовляют из губчатой Pt (платины) с сильно развитой поверхностью (платиновая чернь) и погружают в раствор кислоты с активностью ионов водорода = 1. Через раствор пропускают Н2 под давлением 1 атм, который адсорбируется Pt. Электродный потенциалы, измеренные по отношению к водородному электроду в стандартных условиях, называются стандартными, если металлический электрод погружен в 1 М раствор своей соли и нормальными, если электрод погружен в 1 N раствор соли.
В зависимости от величины и знака стандартного электродного потенциала относительно потенциала водородного электрода все металлы можно расположить в ряд напряжений и ряд, установленный Н.Н. Бекетовым, по взаимному вытеснению металлов.
Например:
На основании ряда напряжений сделано 2 важных заключения:
1) металлы, обладающие более отрицательным электродным потенциалом, способны вытеснять менее активные металлы из водных растворов их солей.
2) металлы, стоящие в ряду напряжений до водорода вытесняют его из кислот
Переход ионов металла с электрода в раствор приводит к равновесию реакции окисления – восстановления. Этому равновесному состоянию отвечает потенциал Е, который можно определить по формуле Нернста.
отношение – концентрации ионов металла
– стандартный потенциал при концентрации иона = 1
- универсальная газовая постоянная
T – t˚ в Кельвинах
Для подсчета э.д.с. элемента следует из величины потенциала более (+) элемента вычесть значение потенциала менее (+) элемента.
Э.д.с. гальванического элемента определяют гальванометром.

Комментариев нет:
Отправить комментарий