Ковалентная связь, как и донорно-акцепторная химическая связь образуется между атомами, расположенными в пространстве друг относительно друга определенным образом – направленно. Это вызвано необходимостью наибольшего перекрывания волновых функций (атомных орбиталей) электронов. По-видимому, чем сложнее конфигурации атомных орбиталей, тем больше возможно вариантов их взаимных перекрываний.
По виду перекрывания волновых функций электронов – связи обозначаются строчными греческими буквами σ, π, d, φ и т.д. созвучно с латинскими s, p, d, f и т.д., обозначающими те атомные орбитали, которые определяют характер симметрии связи.
σ связи и π-связь мы разобрали в предыдущей лекции.
Направленность ковалентных связей в пространстве придает многоатомным частицам (радикалам, молекулам, ионам) определенную форму – конфигурацию. От неё зависит внутренняя структура вещества, а следовательно, и его свойства. Поэтому вопрос о расположении в пространстве атомных орбиталей и об их взаимном влиянии требует рассмотрения.
Чем полнее в пространстве перекрываются друг с другом две атомные орбитали, участвующие в химической связи, тем меньшим запасом энергии обладают электроны, находящиеся в области перекрывания и осуществляющие связь между этими атомами.
При образовании молекулы вместо исходных атомных s, p, d, f – формы образуются такие равноценные «смешанные» орбитали или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии.
Но более полное перекрывание электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии.
Например: рассмотрим молекулу BeF2, ZnCl2, CdCl2, HgJ2 и т.д.
 |
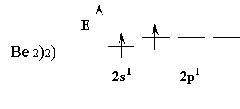

Молекула состоит из одного атома бериллия и двух атомов фтора.
Вместо исходных s и p орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sp). Образующие более вытянутые формы sp орбиталей образуют более прочную связь и энергетически более выгодную. Этот процесс называется sp – гибридизацией. 2 орбитали будут направлены друг к другу под углом в 180˚ и иметь противоположные знаки (+) и (-).

Комментариев нет:
Отправить комментарий